Algunos de estos medicamentos pueden ser considerados críticos por los Estados miembros de la UE. La suspensión de la autorización de comercialización considerada (s) se puede diferir por el período por el cual el medicamento se considera crítico.
A petición de la Comisión Europea, el Comité de la EMA de Medicamentos de Uso Humano (CHMP) reviso más de 1.000 formas farmacéuticas y dosis de los medicamentos genéricos estudiados por la India GVK Biosciences. Más de 300 de ellos, tienen suficientes datos de apoyo de otras fuentes; por lo tanto, éstos permanecerán en el mercado en la UE.
Para los medicamentos que carecen de datos de otros estudios, el CHMP recomendó la suspensión a menos que sean de importancia crítica para los pacientes porque las alternativas no sean capaces de satisfacer las necesidades de los pacientes. Dado que No hay evidencia de daño o falta de eficacia vinculada a la realización de estudios por GVK Biosciences.
La decisión sobre si un medicamento es critico para los pacientes corresponde a las autoridades nacionales de los Estados miembros de la UE en función de la situación en su país. Para los medicamentos que se consideran críticos, las empresas tienen 12 meses para presentar datos adicionales.
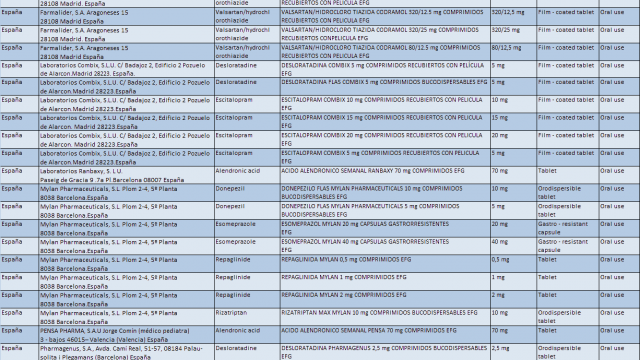
La lista completa de los medicamentos para los que el CHMP recomienda la suspensión está disponible en el sitio web de la EMA. En España esta recomendación afecta a los 30 medicamentos genéricos de la tabla, y puedes descargarla aquí:
La inspección de GVK que llevó a la recomendación del CHMP se llevó a cabo por la agencia francesa de medicamentos (ANSM). La inspección reveló manipulaciones de datos de electrocardiogramas (ECG) durante la realización de algunos estudios sobre los medicamentos genéricos. Estas manipulaciones parecen haber tenido lugar durante un período de al menos cinco años. Su carácter sistemático, el largo período de tiempo durante el cual se llevaron a cabo y el número de miembros del personal involucrado pone en duda la integridad de la forma en la que los ensayos se llevaron a cabo en general y sobre la fiabilidad de los datos generados en ese sitio.
EMA y las autoridades nacionales trabajan en estrecha colaboración con los socios internacionales para garantizar que los estudios que sustentan las autorizaciones de comercialización en la UE se llevan a cabo con los más altos estándares y que las empresas que participan cumplen plenamente con todos los aspectos de la Buena Práctica Clínica (BPC).
La recomendación del CHMP será enviada a la Comisión Europea para una decisión jurídicamente vinculante. Esta decisión se aplicará a todos los Estados miembros, con independencia de si tienen o no han tomado medidas provisionales para suspender los medicamentos.
Información para pacientes y profesionales de la salud
Un número de medicamentos se están considerando para la suspensión en los países de la UE tras las preocupaciones acerca de cómo pueden haber llevado a cabo estudios en el sitio GVK Biosciences en Hyderabad, India. Los pacientes y los profesionales de la salud son informados de lo siguiente:
- No hay evidencia de daño o falta de eficacia con alguno de los medicamentos vinculados a estudios realizados por GVK.
- Algunos medicamentos, si las alternativas disponibles son insuficientes para satisfacer las necesidades de los pacientes, se mantendrán en el mercado en algunos países mientras se esperan nuevos datos.
- Las autoridades nacionales tendrán en cuenta la disponibilidad de otros medicamentos en sus países y tomaran decisiones finales sobre la posibilidad de suspenderlos o permitirles continuar en el mercado,a la espera de nuevos datos.
- Los pacientes deben continuar tomando sus medicamentos según las indicaciones.